
近幾年外泌體(tǐ)研發持續升溫,全球科研大(dà)咖紛紛紮堆此領域,有(yǒu)關外泌體(tǐ)載藥、診斷、免疫療法等方向的文章陸續發表在Science、Nature等各大(dà)頂級期刊上(shàng),外泌體(tǐ)已成為(wèi)生(shēng)命科學/基礎醫(yī)學研究的一大(dà)熱點。


圖片來(lái)自期刊
外泌體(tǐ)是由哺乳動物細胞主動向胞外和(hé)體(tǐ)液中釋放的納米級雙層囊泡小(xiǎo)體(tǐ),攜帶多(duō)種遺傳物質,可(kě)通(tōng)過自分泌或旁分泌途徑被細胞吸收,也可(kě)經循環系統被遠距離靶組織或器(qì)官所吸收,能參與機體(tǐ)多(duō)種生(shēng)理(lǐ)和(hé)病理(lǐ)過程。

外泌體(tǐ)于1983年首次在體(tǐ)外培養的綿羊紅細胞上(shàng)清液中發現且能被多(duō)種細胞分泌。最初外泌體(tǐ)被認為(wèi)是細胞成熟過程中調節膜功能而釋放的多(duō)餘膜蛋白,是清除細胞碎片和(hé)淘汰細胞表面分子的細胞器(qì)。後來(lái)越來(lái)越多(duō)的研究發現,外泌體(tǐ)在介導炎症反應、細胞增殖、調節細胞外微環境和(hé)誘導機體(tǐ)免疫反應等方面都發揮着重要作(zuò)用。
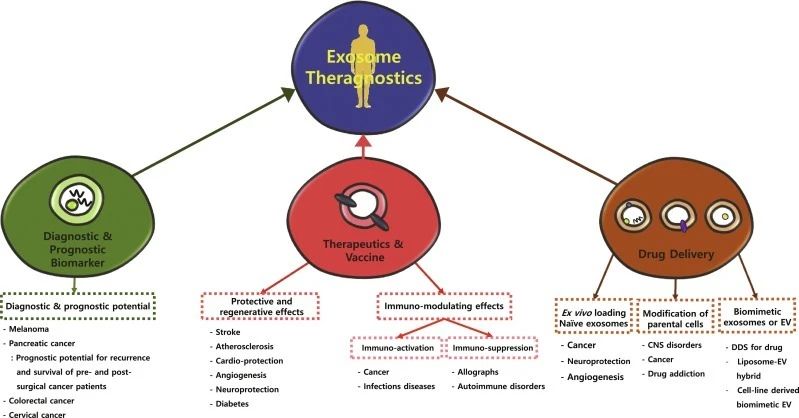
如今,外泌體(tǐ)被認為(wèi)是疾病的生(shēng)物标志(zhì)物和(hé)預後因子,另外還(hái)有(yǒu)潛力作(zuò)為(wèi)基因和(hé)藥物遞送的載體(tǐ),具有(yǒu)重要的臨床意義。
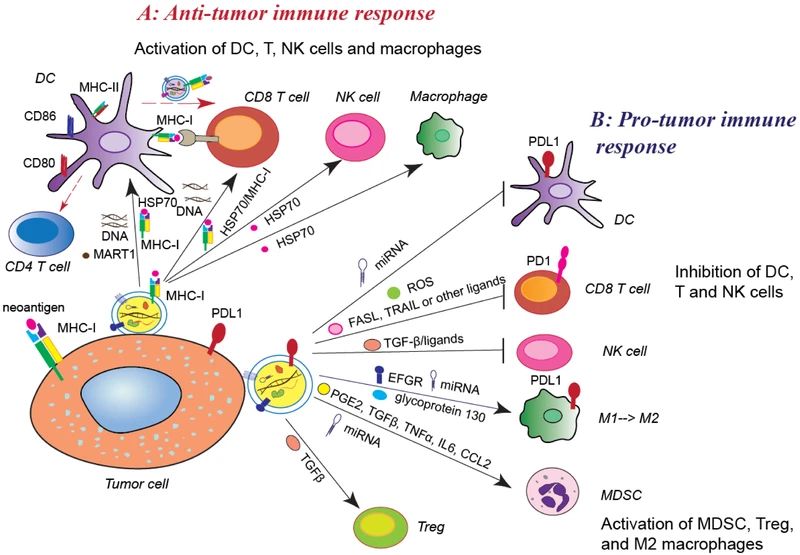
02外泌體(tǐ)作(zuò)為(wèi)藥物輸送系統 外泌體(tǐ)由于其表面具有(yǒu)多(duō)種粘附蛋白已經成為(wèi)基因治療的潛在載體(tǐ),納米尺寸和(hé)柔韌性使它們能夠跨越主要的生(shēng)物屏障,如血腦(nǎo)屏障(BBB)等。 與脂質體(tǐ)制(zhì)劑相反,外泌體(tǐ)是天然存在的分泌性膜囊泡,毒性較低(dī),從它們在體(tǐ)內(nèi)普遍存在可(kě)以推斷出其在體(tǐ)內(nèi)的耐受性很(hěn)好。另外,外泌體(tǐ)固有(yǒu)的歸巢能力暗示了它們在藥物遞送中的潛在效用。例如,源自黑(hēi)色素瘤的外泌體(tǐ)優先進入前哨淋巴結,這種歸巢能力可(kě)以用作(zuò)藥物的靶向遞送。 Alvarez-Erviti等人(rén)研究發現DC衍生(shēng)的外泌體(tǐ)可(kě)将siRNA傳遞給小(xiǎo)鼠的大(dà)腦(nǎo),繼而推斷出外泌體(tǐ)加載的藥物或siRNA可(kě)以通(tōng)過BBB。他們首先轉導DC以表達外泌體(tǐ)膜蛋白LAMP2B,該蛋白能與神經元特異性RVG肽融合。純化的DC外泌體(tǐ)中裝有(yǒu)靶向BACE1(阿爾茨海默病的發病機理(lǐ)中的重要調控基因)的外源siRNA,然後将這些(xiē)iExosome靜脈注射到小(xiǎo)鼠體(tǐ)內(nèi)。這些(xiē)外泌體(tǐ)特異性進入大(dà)腦(nǎo)中的神經元、小(xiǎo)膠質細胞和(hé)少(shǎo)突膠質細胞,導緻小(xiǎo)鼠模型中BACE1基因敲低(dī)。這項研究證明(míng)了外泌體(tǐ)特異性全身遞送的可(kě)行(xíng)性,更重要的是,該研究表明(míng)外泌體(tǐ)可(kě)以通(tōng)過生(shēng)物屏障,表明(míng)了基于RNAi的新型腦(nǎo)腫瘤、腦(nǎo)轉移瘤治療的可(kě)能性。 外泌體(tǐ)天然适于運輸蛋白質、mRNA、miRNA、各種非編碼RNA、線粒體(tǐ)DNA以及基因組DNA,這使得(de)它們可(kě)用于遞送幹擾RNA以及其他治療性物質(如親脂性小(xiǎo)分子),已有(yǒu)研究将抗炎劑姜黃素、抗癌劑阿黴素和(hé)紫杉醇等裝載到外泌體(tǐ)囊泡中用于相應疾病的治療。基于外泌體(tǐ)的藥物遞送系統由于其內(nèi)源性在癌症的治療中具有(yǒu)極大(dà)優勢,能使得(de)免疫原性和(hé)毒性最小(xiǎo)化。例如,一些(xiē)研究表明(míng),與其他遞送系統相比,加載到外泌體(tǐ)中的阿黴素的治療功效大(dà)大(dà)增強,并且對主要器(qì)官系統(尤其是心髒)的不良影(yǐng)響明(míng)顯減少(shǎo)。 03 外泌體(tǐ)作(zuò)為(wèi)癌症免疫療法 最近,免疫檢查點療法在幾種癌症類型中的成功提高(gāo)了人(rén)們對進一步探索腫瘤中免疫失調的興趣,其中包括外泌體(tǐ)腫瘤免疫療法,有(yǒu)望誕生(shēng)抗癌疫苗。 04 外泌體(tǐ)的抑制(zhì) 外泌體(tǐ)水(shuǐ)平升高(gāo)通(tōng)常與不同類型的癌症惡化相關,一些(xiē)研究人(rén)員希望能通(tōng)過降低(dī)腫瘤外泌體(tǐ)到正常水(shuǐ)平來(lái)防止不良預後。 從這個(gè)角度出發,許多(duō)正在進行(xíng)的研究旨在通(tōng)過調節外泌體(tǐ)生(shēng)成分泌的過程或通(tōng)過特異性靶向其成分抑制(zhì)其與靶細胞的相互作(zuò)用來(lái)調節外泌體(tǐ)的産生(shēng)。 參考文獻 1. H Rashed, M., Bayraktar, E., K Helal, G., Abd-Ellah, M. F., Amero, P., Chavez-Reyes, A., & Rodriguez-Aguayo, C. (2017). Exosomes: From Garbage Bins to Promising Therapeutic Targets. International journal of molecular sciences,18(3),538. https://doi.org/10.3390/ijms18030538 2. Zhang, L., & Yu, D. (2019). Exosomes in cancer development,metastasis,and immunity. Biochimica et biophysica acta. Reviews on cancer,1871(2),455–468. https://doi.org/10.1016/j.bbcan.2019.04.004 3. Kang J. S. (2020). The potential of exosomes as theragnostics in various clinical situations.Exosomes,467–486. https://doi.org/10.1016/B978-0-12-816053-4.00020-1 4. Gurunathan, S., Kang, M. H., Jeyaraj, M., Qasim, M., & Kim, J. H. (2019). Review of the Isolation, Characterization, Biological Function, and Multifarious Therapeutic Approaches of Exosomes.Cells,8(4),307. https://doi.org/10.3390/cells8040307 5. 吳金恩, & 丁軍濤. (2016). 外泌體(tǐ)生(shēng)物學功能及應用研究進展. 動物醫(yī)學進展, 037(012), 90-94. 6. 吳奇, 楊國棟, 韋夢影(yǐng), 馬雪, & 陳輝. (2016). 外泌體(tǐ)的生(shēng)物學功能及其在基因治療中的應用. 現代生(shēng)物醫(yī)學進展(34), 6785-6788. 免責聲明(míng):我們尊重原創,也注重分享。部分素材來(lái)源網絡,版權歸原作(zuò)者所有(yǒu),如有(yǒu)侵權請(qǐng)聯系删除。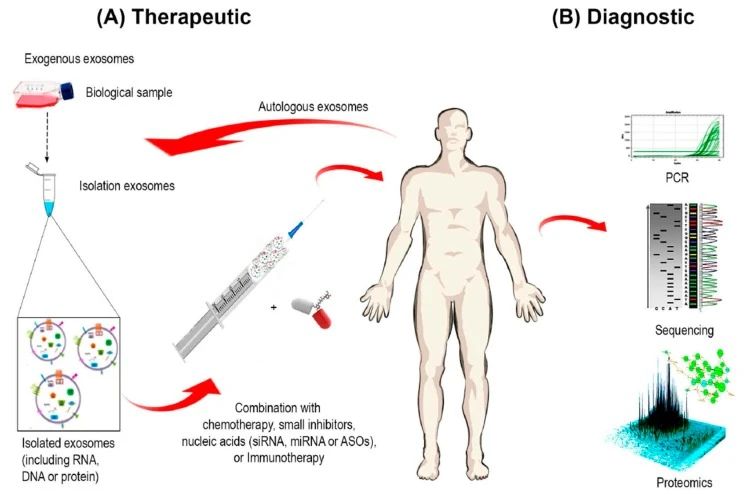
上(shàng)一篇:點贊!北京首張CAR-T細胞治療産品生(shēng)産許可(kě)證獲批!中國藥谷
下一篇:暫無